La grande saga des antipaludiques
Partie 1. Du Quinquina a la quinine: entre légendes et sérendipité.
par Claude Monneret, membre de l’Académie nationale de Pharmacie, juin 2020
L’histoire de la découverte de la quinine [1-3] est passionnante à plus d’un titre. Elle représente un progrès thérapeutique d’une universalité rarement égalée, et sa découverte dont l’origine n’est pas formellement établie est un mélange de légendes et de sérendipité.
Les quinquinas sont des arbustes non caduques de la famille des Rubiacées comme le caféier, originaire des hautes forêts (1500 à 2700 m) de l’Équateur, du Pérou et de la Bolivie. Nommés cinchona ou quina quina par les indigènes, leurs écorces semblent avoir été de longue date, bien avant l’arrivée des espagnols en tous cas, utilisées pour leur propriété antipyrétique. Ce qui va susciter leur intérêt par la suite, ce sont les propriétés antipaludéennes des extraits de ces écorces, et il est difficile de démêler le vrai du faux quant à leur développement en tant que tel.
 L’une des légendes voudrait que cette propriété ait été découverte par sérendipité, C’est ainsi qu’en 1631 un jésuite venu du Pérou rapporta un petit paquet d’écorce de quinquina que les Indiens absorbaient, pilée, pour lutter contre les frissons de la fièvre. Ce jésuite pensait qu’elle pouvait aussi servir de fébrifuge contre les frissons causés par la malaria (le paludisme en francais), aussi appelée fièvre quarte ou intermittente. C’est le père Domenico Anda, le patron des apothicaires de l’Ospedale (hopital) Santo Spirito, qui fit la première prescription de Corticus peruvianus, « l’écorce péruvienne », bref, de cet alcaloïde qu’est la quinine. Pendant près de cent ans, toute la quinine livrée en Europe viendrait, sous forme d’extraits de plantes, de la botica créée par un autre apothicaire jésuite installé à Lima, Agustino Salumbrino. Au cours des deux siècles qui suivirent, plusieurs naturalistes traverseraient les océans pour venir étudier le quinquina dans son habitat naturel.
L’une des légendes voudrait que cette propriété ait été découverte par sérendipité, C’est ainsi qu’en 1631 un jésuite venu du Pérou rapporta un petit paquet d’écorce de quinquina que les Indiens absorbaient, pilée, pour lutter contre les frissons de la fièvre. Ce jésuite pensait qu’elle pouvait aussi servir de fébrifuge contre les frissons causés par la malaria (le paludisme en francais), aussi appelée fièvre quarte ou intermittente. C’est le père Domenico Anda, le patron des apothicaires de l’Ospedale (hopital) Santo Spirito, qui fit la première prescription de Corticus peruvianus, « l’écorce péruvienne », bref, de cet alcaloïde qu’est la quinine. Pendant près de cent ans, toute la quinine livrée en Europe viendrait, sous forme d’extraits de plantes, de la botica créée par un autre apothicaire jésuite installé à Lima, Agustino Salumbrino. Au cours des deux siècles qui suivirent, plusieurs naturalistes traverseraient les océans pour venir étudier le quinquina dans son habitat naturel.
 Selon une autre version décrite en 1663 par Caldera de Heredia un médecin lusitano-espagnol, les pères jésuites eurent l’idée d’utiliser la poudre des fièvres après avoir vu des mineurs indiens grelotant de froid après la traversée d’un torrent, prendre de l’écorce d’un arbre pour soulager leurs tremblements. Par analogie, ils supposèrent qu’un remède calmant les tremblements pouvait être employé pour soigner les fièvres intermittentes.
Selon une autre version décrite en 1663 par Caldera de Heredia un médecin lusitano-espagnol, les pères jésuites eurent l’idée d’utiliser la poudre des fièvres après avoir vu des mineurs indiens grelotant de froid après la traversée d’un torrent, prendre de l’écorce d’un arbre pour soulager leurs tremblements. Par analogie, ils supposèrent qu’un remède calmant les tremblements pouvait être employé pour soigner les fièvres intermittentes.
Autre version longtemps accréditée, celle selon laquelle, les indiens connaissaient depuis très longtemps les propriétés fébrifuges de la poudre qu’ils tiraient de l’écorce de l’arbre. L’exemple cité est celui de la guérison de la comtesse de Chinchon, dona Franscisca Henriquez de Ribera, épouse de don Luis Jeronimo Fernandez de Cabrera y Bobadilla, vice roi du Pérou. Celle-ci atteinte de fièvre intermittente et de frissons ne répondait à aucun traitement, son état empirant de jour en jour. On en vint à craindre pour ses jours jusqu’à ce que cette nouvelle parvint aux oreilles du prévôt de Loja, don Juan Lopez de Canizares qui fit porter au vice-roi, un paquet d’écorces de quinquina accompagné du mot suivant : « Altesse, humblement et respectueusement, je vous fais porter par mon serviteur quelques morceaux d’écorces de l’arbre quinaquina qui pousse sur ce territoire. Vous pouvez le rendre agréable au goût en le mêlant, une fois pulvérisé, avec du vin fort et si Dieu le veut, cela guérira la comtesse « Cette dernière prit donc la décoction et la fièvre disparut dès le second jour et la guérison ne se fit guère attendre.
 Belle histoire à propos de laquelle subsistent des doutes car son époux le comte ne mentionne pas cet évènement dans son Journal officiel qui couvre cette période. Ceci est d‘autant plus étrange que ce journal traite au jour le jour les plus minimes activités du comte or rien sur ce traitement.
Belle histoire à propos de laquelle subsistent des doutes car son époux le comte ne mentionne pas cet évènement dans son Journal officiel qui couvre cette période. Ceci est d‘autant plus étrange que ce journal traite au jour le jour les plus minimes activités du comte or rien sur ce traitement.
Néanmoins, Linné, recevant des écorces de la part de Celestino Mutis, un médecin naturaliste espagnol dirigeant une expédition scientifique en Nouvelle-Grenade (aujourd’hui la Colombie) créa en 1742 le genre Cinchona en hommage à la comtesse de Chinchon, tout en déformant son nom [4]. Hippolyte Ruiz, un autre botaniste d’origine espagnole, chef d’une expédition au Pérou, en fit la remarque en 1992 dans son ouvrage la Quinologia ou Quinologie en francais mais Linné ayant disparu entre temps (en 1778), l’orthographe proposé par Linné fut conservé. [5]
Un ouvrage du même nom sera le traité rédigé par les pharmaciens Augustin-Pierre Delondre (1790-1865) et Apollinaire Bouchardat (1806-1886), qui s’intitule Quinologie. Des Quinquinas et des questions qui, dans l’état présent de la science et du commerce, s’y rattachent avec le plus d’actualité (1854). Selon ces auteurs, leur but de ce traité pratique est le suivant : préciser la dénomination, la classification et l’efficacité thérapeutique des différentes espèces de Quinquinas, en se basant sur leur origine géographique, ainsi que sur la teneur en alcaloïdes de leurs écorces [6)
 Toujours à propos de la découverte des propriétés de ces quinquinas, selon une autre version plus vraisemblable, ce seraient les jésuites missionnaires qui mirent la main sur cette poudre précieuse, ayant observé que les mineurs péruviens consommaient de la poudre d’écorce macérée dans de l’eau après avoir été exposé au froid et à l’humidité. Ces jésuites s’enrichirent ainsi en la vendant sous le nom de « poudre des Jésuites ».
Toujours à propos de la découverte des propriétés de ces quinquinas, selon une autre version plus vraisemblable, ce seraient les jésuites missionnaires qui mirent la main sur cette poudre précieuse, ayant observé que les mineurs péruviens consommaient de la poudre d’écorce macérée dans de l’eau après avoir été exposé au froid et à l’humidité. Ces jésuites s’enrichirent ainsi en la vendant sous le nom de « poudre des Jésuites ».
Le remède arrive en Espagne, vers 1620 par les soins de Barnabé de Cobo, jésuite procurateur de la province du Pérou mais la diffusion de la poudre de quinquina à l’ensemble de l’Europe se fera à partir de Rome. Finalement c’est le cardinal de Lugo, jésuite avisé et entreprenant. Issu d’une famille de la haute noblesse de Séville qui enthousiasmé par l’annonce des effets du quinquina, en parle au pape qui charge son médecin, Fonseca, de l’étudier. Après l’avoir expérimentée sur les habitants de la campagne romaine, celui-ci déclare qu’elle vient à bout des fièvres et qu’elle est dépourvue d’effet nocif. Dès lors, la « poudre des jésuites » ou encore « poudre cardinale » va être plus largement utilisée comme fébrifuge Elle se répand dans toute l’Europe mais les résultats ne sont pas toujours au rendez-vous, peut-être par une mauvaise utilisation du produit, une malfaçon car les fraudes se multiplient devant l’augmentation de la demande. Quelles que soient les réponses apportées à ces questions, les réactions négatives seront nombreuses. A l’opposé, et il faudra toute l’aura d’un médecin anglais du nom de Thomas Sydenham, qualifié d’hippocrate anglais, pour rétablir sa réputation. Il publie en 1666, dans Methodus curandi febres, des résultats remarquables avec le quinquina au cours des fièvres intermittentes. Deux autres personnages vont lui apporter leur soutien, en France, Charles Barbeyrac, docteur de Montpellier et en Italie, Sébastiano Baldo.
 Un anglais peu scrupuleux du nom de Talbot ayant découvert leur secret, se met à leur faire concurrence, d’abord en Angleterre puis en France. Médecin personnel du roi Charles II. Il vient en France pour soigner Marie-Louise d’Orléans, la fille de Monsieur, frère du roi. 7]Il traite également le dauphin et toute la famille royale [7]. Fort intéressé, il ne tarde pas à faire fortune. Selon Madame de Sévigné, il faisait payer 400 pistoles chaque dose de son remède. L’exemple royal devient une référence pour bien des courtisans qui veulent s’en procurer. Cette poudre dont le secret est bien gardé sera connue en France sous le nom de « remède anglois ».
Un anglais peu scrupuleux du nom de Talbot ayant découvert leur secret, se met à leur faire concurrence, d’abord en Angleterre puis en France. Médecin personnel du roi Charles II. Il vient en France pour soigner Marie-Louise d’Orléans, la fille de Monsieur, frère du roi. 7]Il traite également le dauphin et toute la famille royale [7]. Fort intéressé, il ne tarde pas à faire fortune. Selon Madame de Sévigné, il faisait payer 400 pistoles chaque dose de son remède. L’exemple royal devient une référence pour bien des courtisans qui veulent s’en procurer. Cette poudre dont le secret est bien gardé sera connue en France sous le nom de « remède anglois ».
Survient alors la « querelle du quinquina » qui oppose Robert en 1682 Talbot à Nicolas de Blégny, premier médecin du roi. Ce dernier publie dans « Le Remède anglois pour la guérison des fièvres « avec les observations de M. le premier Médecin de S. M. une attaque dans laquelle il rejette l’idée selon laquelle le remède serait nouveau. L’innovation de Talbot consiste en une préparation assez rudimentaire précisant la quantité de quinquina par pinte de vin et des prises espacées de deux heures, plusieurs fois par jour. Talbot estime que huit onces pourraient venir à bout de toute fièvre.
Au passage, il en modifie la préparation : il faut laisser le quinquina infuser plus longtemps et on ne saurait le prescrire en cas de fièvre causée par des « dévoyemens excitez par l’intempérie des viscères et l’irritation d’une bile répandue ». Il ne faut pas non plus nourrir le patient immédiatement après le traitement. »
À cette époque, le paludisme sévit un peu partout en France, des Flandres à la Camargue en passant par les marais de la Brenne, le marais poitevin, ou la Sologne pour ne citer que les régions les plus touchées [8,9].. Les Solognots étaient d’ailleurs souvent surnommés les « ventres jaunes », le paludisme infectant les cellules hépatiques. La fièvre donnait la « tremblote », d’où le nom de Tremblevif donné jusqu’en 1854 au village de Saint-Viâtre, en plein cœur de la Sologne des étangs.
Le fils de Louis XIV, le grand Dauphin de France, fut à son tour atteint d’un accès palustre en 1679 alors qu’on assainissait les marais de Versailles. La « poudre des Jésuites » ayant fait son effet, le Roi-Soleil demanda à l’apothicaire Royal de publier un document sur les bienfaits de ce remède.

Le « nouveau » remède fait parler de lui et passionne l’élite cultivée. On aborde le sujet dans les salons, d’où le célèbre Poème sur le quinquina de La Fontaine, dédié à la duchesse de Bouillon. Aux Italiens on célèbre ce quinquina en jouant une pièce intitulée : « le remède anglois ou Harlequin, prince de Quinquina ».
Le succès du quinquina est définitivement établi lorsque Daquin l’utilise avec succès sur le roi pour venir à bout des poussées fébriles qui accompagnent la suppuration d’une fistule anale avant que celle-ci soit opérée.
L’exemple royal va susciter l’engouement des courtisans toujours soucieux d’imiter le roi. Dans une lettre que Racine écrit a Boileau en 1687, il souligne ceci dans les termes suivants : « On ne voit a la cour que des gens qui ont le ventre plein de quinquina ». Le soit-disant secret de Talbot étant éventé, celui-ci va disparaitre de la cour et de l’histoire.
Les pharmacopées officielles n’accorderont pas au quinquina la place qu’on croirait devoir lui être attribuée. Pour beaucoup, le quinquina ne constituerait qu’un remède parmi des milliers d’autres si le nom de Louis XIV n’y était implicitement associé.
La Fontaine en fait l’éloge dans le « Poème du quinquina » (1682). À la fin du XVIIIe siècle, plus personne ne doute que l’écorce de l’arbre appelé Cinchona par Linné en 1753, ou encore quinquina, contient un principe actif contre les fièvres. Elle entre dans la pharmacie des vaisseaux de ligne britanniques. Mais l’efficacité des écorces, jaune, rouge ou grise, obtenues d’arbres de la côte ou de la montagne, est variable ; en outre, bien des contrefaçons circulent.
Sous Louis XV, en 1735, l’Académie royale des Sciences envoya une expédition scientifique au Pérou. C’est Charles Marie de La Condamine, explorateur, astronome et encyclopédiste du XVIIIe siècle qui se rend à Lima, au début de 1737 avec Joseph de Jussieu, médecin généraliste à ses côtés. Le but premier de ce voyage était d’effectuer des mesures d’un arc méridien. Joseph de Jussieu profita de son séjour péruvien pour collectionner les spécimens de quinquina et en faire la description, mais suite à des vols et une série de naufrages l’ensemble du travail du médecin naturaliste fut perdu à l’exception d’une étude des quinquinas de la région de Loja qui avait été remise à La Condamine. Celui-ci, dénué de tout scrupule, s’empressa d’envoyer en France ces notes « revues et corrigées de sa main ». Ainsi, la communication à l’Académie royale des Sciences en 1737 sur « L’étude du quinquina, de ses vertus, de la meilleure manière d’en extraire le suc » ne parût pas sous le nom de Jussieu mais sous celui de la Condamine.
|
Cet arbre ainsi formé se couvre d’une écorce |
(Extrait du poème de La Fontaine.)
La quinquina jouit alors d’une réputation formidable. Manon Roland, égérie des Girondins, celle qui deviendra sous la plume de Lamartine, Stendhal ou Michelet une légende, une « héroïne de la révolution et une martyre de la liberté, convalescente, écrit à son mari le 3 janvier 1782. « Eh bien, j’ai eu encore une nuit calme et délicieuse, un sommeil doux et restaurant ; quinquina, vin d’Espagne me font digérer parfaitement : je suis à la nourriture ordinaire, avec quelques précautions cependant. » [10]
Vers l’élucidation de la quintessence, la recherche du principe actif.
Ce sont tout d’abord les travaux du comte de la Garaye et de son épouse [11]. Bouleversée par la mort subite de sa sœur, le comte et son épouse, délaissant la vie mondaine décident de servir les pauvres pour l’amour de Dieu. Leur château est transformé en hôpital pour accueillir, nourrir et soigner les pauvres. Ils vendent leurs biens pour financer leur œuvre et se mettent à l’œuvre avec leurs domestiques. Ils se forment à la médecine, à la chirurgie et à la chimie à Paris en 1714. Le comte développe un laboratoire de chimie pour la création de médicaments. Le roi Louis XV l’encourage dans cette voie à Marly en 1731 et lui achète la méthode pour extraire les « sels essentiels » des plantes médicinales. Il publie en 1745 un livre intitulé : Chimie hydraulique, pour extraire les sels essentiels des végétaux, animaux et minéraux, avec l’eau pure ou il traite du quinquina par la nouvelle chimie. Il expose essentiellement la façon d’absorber le quinquina soulignant que le quinquina bien choisi est un des meilleurs remèdes dans les fièvres intermittentes. C’est ainsi qu’il préconise différentes façons d’absorber le quinquina, « en substance ou en infusion, en bol ou en tisane, en sirop ou en extrait, seul ou mêle avec d’autres drogues », ajoutant plus loin que « le sel essentiel de quinquina de La Garaye est une préparation efficace et facile à prendre ». On lui doit la préparation de l’extrait sec de Quinquina longtemps appelé « sel de La Garaye ».
Compte tenu de l’intérêt thérapeutique des quinquinas, de nombreuses analyses vont susciter l’intérêt d’un grand nombre de chimistes et de …. Faussaires [12]. Les premières analyses dignes d’une attention spéciale sont celles qui ont été faites par Buquet et Cornette en 1779 chargés par la société royale de médecine de France d’examiner deux échantillons (poudre d’écorce) de quinquina envoyés de Santa Fé de Bogota [13]. Ils proposent un nouveau « sel essentiel » de quinquina. Ici comme dans précédemment il semble bien que l’on ait eu affaire à un sel de calcium de l’acide quinique.
Toujours en relation avec des études plus ou moins approximatives de ces quinquinas, se succèdent ensuite les noms de Guillaume Saunders, un médecin anglais, de Jacques Schot, de Vitet un médecin de Lyon, de Marabelli un professeur de chimie a Paris, du docteur Mallet, Moretti…….
Antoine François de Fourcroy dont le nom est rarement évoqué, n’a jamais manqué de s’intéresser à la thérapeutique et aux apports que la chimie nouvelle pouvait et devait lui apporter. En 1791, il présenta ses analyses du quinquina de Saint Domingue. Il conclut ses travaux par une ces phrases visionnaires : « Ces expériences faites avec soin, (…), donneront certainement des lumières sur un des médicaments les plus précieux que la médecine possède. Elles jetteront peut être aussi quelque jour sur une découverte dont nos recherches nous ont fait entrevoir la possibilité ; celle d’une substance anti-périodique, fébrifuge, qui, une fois connue, pourroit être trouvée et extraite dans d’autres végétaux. Nous faisons des vœux pour que de pareils travaux soient entrepris sur les grands médicaments que l’art possède, et dont il tireroit sans doute un parti bien avantageux encore, si leurs principes étoient mieux connus. »(14]
Dans cet inventaire il faut également mentionner le nom de Deschamps un pharmacien de Lyon qui « est parvenu à retirer, d’une livre de quinquina jaune, jusqu’à trois onces d’un sel cristallisé, à acide végétal et à base de chaux, qu’il a nommé quinquinate de chaux. » Son procédé fut d’ailleurs publié dans les Annales de chimie [15]
Plus tard, Napoléon Ier, malgré ses préoccupations multiples, n’oublia pas le rôle salutaire du quinquina et en ordonna des distributions aux armées ainsi qu’à ses bonnes villes de France en 1809.
La notion d’alcaloides
L’idée prévalait en ce temps, que les végétaux ne contenaient que des substances neutres ou acides, ces dernières combinées à des alcalis ou alcalino-terreux minéraux. C’est à cette période que née le nom d’alcaloïde. Ce mot a, semble-t-il, été forgé par l’anglais William Thomas Brande selon les uns, par l’allemand Messner outre-rhin en 1817, selon les autres.
Quoiqu’il en soit Derosne, pharmacien à Paris peut être considéré comme un des pionniers de l’isolement de ces alcaloides (16]. En 1813, par traitement à l’alcool de l’opium, il extrait une substance active que l’allemand Sertürner identifie en 1815 au méconate d’un alcali végétal qu’il nomme morphine (morphium), premier alcaloïde connu ? Ceux-ci furent un peu oubliés au profit de Vauquelin qui jouissait alors d‘une véritable vénération. On considéra a cette époque que c’est lui qui le premier avait eu l’idée de l’existence des alcalis végétaux lors de ses recherches sur le Daphne alpina résultats qu’il publia en 1812
C’est alors qu’intervient Vauquelin qui va procéder à une étude systématique de dix-sept espèces de quinquina à l’aide de divers réactifs (tannins, géatine, émétique..) ce qui lui permet de classer les différents quinquinas. Il réussit à obtenir une substance amère, résiniforme ou est concentrée l’activité. En revanche il isole et caractérise le kinate de chaux, déjà connu sous le nom de « sel de Deschamps ».{17]
Isolement de la quinine.
 En 1820, poursuivant l’isolement par précipitation acide-base de substances actives des plantes médicinales, les deux pharmaciens parisiens, Joseph Bienaimé Caventou et Pierre Joseph Pelletier, extraient de l’écorce de quinquina jaune un mélange de substances amer et basique, dans lequel prédomine donc un alcaloïde, la quinine [18].
En 1820, poursuivant l’isolement par précipitation acide-base de substances actives des plantes médicinales, les deux pharmaciens parisiens, Joseph Bienaimé Caventou et Pierre Joseph Pelletier, extraient de l’écorce de quinquina jaune un mélange de substances amer et basique, dans lequel prédomine donc un alcaloïde, la quinine [18].
 Petit fils et fils de maîtres –apothicaire, Pierre-Joseph Pelletier fut reçu pharmacien en 1810 et dès 1811 publiait dans les Annales de Chimie une analyse de différentes résines dont celles d’une plante méridionale l’Opoponax suivie en 1814 d’études sur la sarcocolle et la gomme d’olivier et sur des matières colorantes comme l’orcanète, le santal rouge et le curcuma. En 1817 sa collaboration avec le médecin et physiologiste François Magendie créateur de la pharmacologie moderne, aboutissait à la découverte de l’émétine, alcaloïde à action antidysentérique extrait de l’épicéa.
Petit fils et fils de maîtres –apothicaire, Pierre-Joseph Pelletier fut reçu pharmacien en 1810 et dès 1811 publiait dans les Annales de Chimie une analyse de différentes résines dont celles d’une plante méridionale l’Opoponax suivie en 1814 d’études sur la sarcocolle et la gomme d’olivier et sur des matières colorantes comme l’orcanète, le santal rouge et le curcuma. En 1817 sa collaboration avec le médecin et physiologiste François Magendie créateur de la pharmacologie moderne, aboutissait à la découverte de l’émétine, alcaloïde à action antidysentérique extrait de l’épicéa.
 De son côté Joseph Bienaimé Caventou né en 1795, était fils de pharmacien militaire pharmacien lui-même vers 1815. Mû par un certain patriotisme, il s’engagea dans l’armée napoléonienne au retour de Napoléon de l’ile d’Elbe puis revint à ses études après la défaite de Waterloo. IL prit alors la direction de la pharmacie de l’hôpital Saint-Antoine. Tout jeune encore, il publia une Nouvelle nomenclature chimique d’après la classification adoptée par Thénard.
De son côté Joseph Bienaimé Caventou né en 1795, était fils de pharmacien militaire pharmacien lui-même vers 1815. Mû par un certain patriotisme, il s’engagea dans l’armée napoléonienne au retour de Napoléon de l’ile d’Elbe puis revint à ses études après la défaite de Waterloo. IL prit alors la direction de la pharmacie de l’hôpital Saint-Antoine. Tout jeune encore, il publia une Nouvelle nomenclature chimique d’après la classification adoptée par Thénard.
Leur rapprochement va être particulièrement fécond. Ils vont ainsi isoler la strychnine en 1818, la brucine en 1819 à partir de la noix vomique ou fève de Saint Ignace , Strychnos nux-vomica, un arbre que l’on trouve en Asie du Sud-Est. A leur actif également, la vératrine en 1919 dans les graines de la cévadille, Veratrum sabadilla, et dans l’hellébore blanc, Veratrum album.
Petite anecdote à propos de la strychine dont l’étude pharmacologique réalisée par Magendie mis en exergue sa toxicité et son activité thérapeutique comme tonifiant musculaire. Pelletier et Caventou souhaitait le nommer « vauqueline » en hommage à leur maitre, Louis-Nicolas Vauquelin. Les commissaires de l’Académie refusèrent cette appellation au motif qu’un « nom chéri ne pouvait être appliqué à un principe malfaisant ». Ils durent donc se résoudre à appeler ce nouvel alcaloïde, la strychnine.
Après ces divers travaux issus de leur collaboration, ce sera la découverte de la quinine qui immortalisera leurs recherches [19]. Pour répondre à la demande du corps médical, soutenue par Magendie, Pelletier créa des ateliers de production hors Paris, à Neuilly-Sablons (actuellement Hauts-de-Seine). Ces ateliers pourront traiter, en 1826, 138 tonnes d’écorce de quinquina et en extraire 1 800 kilos de sulfate de quinine. Il s’agit là d’une première firme de production pharmaceutique.
N’ayant pas protégé leur découverte, plusieurs entrepreneurs allemands vont se lancer dans l’extraction à grande échelle de la quinine alors qu’aux États-Unis, le laboratoire Rosengarten and Sons, établi à Philadelphie, commence à faire un usage commercial de la méthode Pelletier-Caventou. La même année, les cloches des temples de la vallée du Mississippi appelaient chaque soir à la consommation des pilules à base de quinine du Dr John Sappington (Dr Sappington’s Fever Pill), ce qui fit la fortune de ce dernier.
C’est le médecin parisien François-Joseph Double, fils d’un apothicaire de Verdun-sur-Garonne et beau-frère de Joseph Pelletier qui en a connaissance et va développer son utilisation. Inventeur de l’auscultation en 1817, Il fut l’un des premiers à étudier cliniquement les effets de la quinine ainsi que d’autres alcaloïdes. C’est ainsi qu’il est amené à tester le sulfate de quinine sur une jeune fille ayant contracté le paludisme à Palaiseau. Il constate qu’au bout de trois jours la fièvre a disparue. Il traite également avec succès un enfant de 9 ans, la fille d’un général, une femme de chambre…… [20]
On vantait ses prescriptions originales, surtout de bols, dont quelques-unes demeurèrent longtemps dans les formulaires. L’histoire retiendra surtout le nom de François de Magendie à qui Pelletier avait envoyé de la quinine pour les tester sur l’animal et sur l’homme. Il note, en 1829, dans son « Formulaire pour la préparation et l’emploi de plusieurs médicaments » : « S’il est toujours du plus haut intérêt pour le médecin de connaître précisément la dose de la substance active contenue dans le médicament qu’il emploie, cet avantage n’est jamais plus manifeste que par rapport au quinquina, dont l’activité varie beaucoup suivant la nature et la qualité des écorce. On est d’ailleurs souvent très heureux de pouvoir administrer ce médicament sous un aussi petit volume et sous une forme qui n’a rien de rebutant. »
Magendie soutient sans réserve la pharmacie chimique, bien qu’il en mesure dès l’origine, les excès et les risques : “chacune de ces substances nous présente un médicament dans sa plus grande simplicité (pureté pharmaco-chimique), mais aussi dans sa plus grande énergie”.
Dès son apparition en thérapeutique, la quinine deviendra un enjeu médical international, et même mondial. Annexé à la publication de Pelletier et Caventou de mars 1821 parue dans le Journal de pharmacie, Magendie fait le rapport de ses essais sous la forme d’une note intitulée : “Sur les propriétés physiologiques et médicamentales de la quinine et de la cinchonine”, texte également fondateur des évaluations contrôlées par l’expérimentation.

La découverte de ces alcaloides fut également attribuée, à Gomes pour la cinchonine et à Runge pour la quinine. S’il est exact que la cinchonine fut bien découverte par Gomes, comme cela est attesté par les travaux que celui-ci publient en 1811 dans les Memorias de Academia da Academia Real des Sciencias de Lisboa puis dans The Edinburg Medical and Surgical Journal, en revanche F.F. Runge en 1819-1820 n’avait isolé qu’un mélange d’alcaloïdes dont le composant principal n’était même pas la quinine.
En 1827, L’académie des Sciences attribue, à l’unanimité, le grand prix Montyon (10 000 francs or) à Pelletier et Caventou soulignant qu’ils sont « dignes d’être à jamais placés parmi ceux des bienfaiteurs de l’humanité ».
D’un autre côté, le 24 février 1825, le libérateur, Simon Bolivar (1783-1830), et le tout jeune Parlement péruvien, fraîchement libéré de la tutelle de l’Espagne, donnèrent leur accord pour que le quinquina figure sur le blason national du pays… Le blason comporte un écu où sont figurés une vigogne (la faune), un arbre de quinquina (la flore) et une corne d’abondance déversant des pièces jaunes (la richesse minérale).

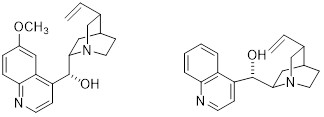
La détermination de la structure de la quinine fera l’objet de nombreux travaux impliquant nombre de chimistes comme Strecker, Skraup, Konigs, Hesse, Rabe….La formule brute de la quinine sera établie en 1854 par Adolph Strecker (1822-1871) et sa structure chimique de quinoleine décrite vers la fin du siècle par Zdenko Skraup et Wilhelm Königs (21]

Partie 2 ; De la quinine à l’hydroxychloroquine
En vue de pallier le manque de quinine d’origine naturelle, les chimistes vont s’y intéresser dès 1849 mais la chimie organique de synthèse est encore balbutiante à cette époque et la structure moléculaire exacte de la quinine non encore établie. Le premier à se manifester est August Wilhelm von Hofmann (1818-1892), directeur du Royal College of Chemistry à Londres, un expert en goudron de houille . En 1849 il déclare « it is obvious that naphthalidine (cf naphthylamine) differing only by the elements of two equivalents of water might pass into quinine simply by an assumption of water ». Il ajoute ensuite : « We cannot of course, expect to induce the water to enter merely by placing it in contact but a happy experiment may attain this end by the discovery oif an appropriate metamorphic process… ».
De leurs côtés, les Français ne sont pas en reste. En 1850, la Société Française de Pharmacie de Paris, crée en 1803 et présidée par Parmentier et Vauquelin lance un appel aux chimistes en offrant une récompense de 4 000 francs pour qui, découvrira une voie de synthèse permettant d’accéder à la quinine et en fournira au moins une demi-llvre, la limite de participation étant fixée au 1er janvier 1851. Cet appel restera sans réponse.
Parmi les élèves du professeur Hofmann, figure William Perkin, 18 ans, étudiant en chimie. En 1856, alors qu’il a seulement 18 ans, Perkin tente de synthétiser la quinine à partir d’aniline. Au lieu de la quinine désirée, il obtient un résidu noir. Esprit curieux, source de serendipité, il remarque que, dilué dans l’alcool, le résidu donne une teinte violette. Perkin teste sa molécule, qui se révèle capable de teindre les tissus, et réalise qu’il peut la commercialiser. Il perfectionne le procédé pour le transposer à l’échelle industrielle, à partir de réactifs peu coûteux.
Il raconte :
« En 1856, encore jeune chimiste, j’essayai de synthétiser la quinine pour combattre le paludisme qui touchait nos fières troupes qui défendaient aux Indes, l’honneur britannique. Après plusieurs essais, j’en arrivai à oxyder un dérivé de l’aniline, l’allyltoluidine. J’obtins vite un splendide précipité rouge-brun. « Bien sûr, ce composé n’avait rien à voir avec la quinine artificielle que je recherchai mais il éveilla cependant ma curiosité de chimiste car, en ayant renversé une petite éprouvette, je vis qu’il produisait sur le parquet et sur ma blouse, des tâches certes belles mais surtout indélébiles. Sans le savoir je venais d’inventer ce colorant de bonne tenue dont l’industrie textile avait tant besoin. « Je l’appelai d’abord « violet allyltoluidin » puis « pourpre d’aniline », mais mon épouse trouvant ce nouveau nom encore trop barbare lui préféra celui de « mauveine » qui fut définitivement adopté.
« Ce fut, pour nous tous, le début d’une période faste chargée de gloire et de richesses. Tout cela pour avoir découvert, par hasard, et breveté, en toute connaissance de cause, le premier colorant artificiel utilisable par l’industrie en toutes quantités.
Ce ne sera qu’en 1918, qu’une première synthèse partielle sera publiée par Paul Rabe et Karl Kindler. En 1944, Robert Burns Woodward et Gilbert Stork publieront la première synthèse de la quinine (21] .
Source naturelle
La quinine sera fabriquée et vendue vers 1830. La matière première provient de la côte ouest de l’Amérique du Sud, où les Indiens locaux sont employés par les Occidentaux lors d’expéditions de récolte des écorces. Cependant, l’exploitation de cette plante va vite poser des problèmes d’approvisionnement et causer d’importants impacts écologiques. Suite à une production accrue de quinine et donc à une cueillette excessive du quinquina, la raréfaction de la source de quinine commence à se faire sentir.
Les premiers à se lancer dans la culture du quinquina sont les Britanniques, vers 1850, dans une petite zone himalayenne chaude et humide (région de Darjeeling) puis à Ceylan pour des problèmes de surfaces cultivables. Ils seront suivis de près par la Hollande, en particulier sur l’île de Java. La Hollande supplantera l’Angleterre après avoir importé d’Amérique du Sud, des graines de plusieurs espèces de quinquina, et avoir réalisé de nombreuses hybridations. Les quinquinas jaunes du groupe » ledgeriana » dont les écorces sont très riches en quinine (12% environ, au lieu de 5%) vont remplacer les quinquinas du groupe succirubra. En trois années, la Hollande va ruiner la culture des planteurs de Ceylan mais l’Angleterre palliera cette catastrophe économique en remplaçant la culture du quinquina par celle du thé. La Hollande gardera le monopole de l’exploitation du quinquina jusqu’en 1939, l’exportation étant centralisée sur Amsterdam.
Il est à peu près certain que la recherche d’antipaludéens de synthèse est liée aux deux guerres mondiales. Peu après la première guerre mondiale de 14-18, les allemands coupés des régions productrices de quinquina avaient développé une recherche intensive pour pallier ce manque. Ces recherches avaient abouti à la production de plasmoquine (ou pamaquine) en 1922 puis ensuite à celle de l’atébrine (ou mépacrine ou quinacrine) en 1926 dans le laboratoire Bayer Elle sera commercialisée en France par Rhône-Poulenc sous licence Bayer.
En 1940, l’Allemagne nazie détruit les stocks lors du bombardement d’Amsterdam et les Japonais envahissent l’île de Java. Du coup les troupes alliées, australiennes et américaines, combattant dans la zone du Pacifique sud n’ont plus les produits nécessaires pour traiter leurs soldats atteints de paludisme. Il leur faut donc prendre des mesures compensatoires. Pour cela les alliés ont le choix entre réaliser la synthèse d’analogues de la quinine, ou introduire des cultures de quinquina en Afrique de l’Ouest (Guinée, Cameroun, Côte d’Ivoire, Congo belge). Cela explique qu’à cette époque, les principaux producteurs et exportateurs de quinquinas sont l’Indonésie et la République démocratique du Congo.
L’occupation japonaise des zones de production de l’écorce de quinquina, et le besoin pressant d’anti-paludéens pour les soldats alliés, stimulèrent la recherche de voies de synthèse. Les antipaludéens de synthèse, avec le même noyau de base (quinoléine), et de coût de fabrication très faible, tendent ensuite à remplacer la quinine d’extraction, plus chère.
Vers les anti paludéens de synthèse, sérendipité oblige.
Dans les années 20, les chimistes de la firme Bayet développent un programme de recherche dans ce domaine, aidé en cela par une technique consistant à tester les produits de synthèse sur des canaris infectés par Plasmodium relictum. Le choix des molécules repose sur une observation antérieure. Dès 1891, Ehrlich de retour d’Egypte où il avait vu les ravages dus au paludisme [7] avaient préconisé une méthode de coloration à base de bleu de méthylène pour mettre en évidence les parasites du paludisme. Il en déduisit que la capacité du bleu de méthylène à colorer le parasite devait certainement altérer ce dernier d’où l’idée d’administrer ce colorant à certains patients infectés par le Plasmodium. Certes, ce ne fut pas un miracle, mais tout de même, les symptômes régressèrent chez quelques-uns d’entre eux. Bien sûr cela ne devait pas remplacer la quinine mais cette observation restait en tête des chimistes de Bayer. Aussi s’engageant dans ce domaine, ils entreprirent de préparer des dérivés du bleu de méthylène.
Il leur suffisait pour cela, d’ajouter une chaîne latérale, de préférence basique. Une chimie pas très complexe, en fait. Toutefois si le composé ainsi préparé est actif, comme le constate Roehl, il a la fâcheuse tendance à colorer la peau du patient qui l’a absorbé en jaune. Une des façons d’éviter cela, était de préparer des composés analogues mais sans le squelette comportant trois cycles insaturés, ce que l’on désigne sous le nom de chromophore, responsable de la coloration. Les chimistes de Bayer (parfois aussi désigné sous le nom d’Ig Farben suite à la fusion en 1918 de Bayer, BASF et Hoechst, pour ne citer que les grands groupes) se tournèrent alors vers un analogue à deux cycles, une amino-8 quinoléine, tout en gardant la même chaîne latérale. Afin d’accroitre la similitude avec la quinine ils lui bnajoutèrent un groupe méthoxyle en position 6 du bicycle. C’est ainsi que va naitre en 1925, le premier antipaludéen de synthèse, la pamaquine 5, premier dérivé synthétique de la quinoléine qui va se montrer efficace contre les parasites du paludisme des canaris.
Au vu de ces résultats, les molécules intéressantes sont ensuite essayées sur des patients syphilitiques atteints de paralysie générale et qui, selon la procédure que Julius Wagner-Jauregg vient d’expérimenter à Vienne, ont été traités par inoculation du paludisme..
Toutefois la toxicité avérée de la pamaquine va conduire les allemands à chercher à faire mieux, ce qui sera le cas avec la mépacrine 3, relativement peu toxique et surtout très active sur les formes asexuées de Plasmodium falciparum. Celle-ci sera préparée chez Ig Farbenindustrie en 1932. Elle comporte un noyau acridine, ce qui signifie trois cycles, avec une longue chaîne aminée. Sa particularité est de colorer la peau après en avoir avalé. Elle sera particulièrement utilisée durant une épidémie à Ceylan en 1935, une épidémie qui fait environ 3 millions de malades et 82 000 morts.
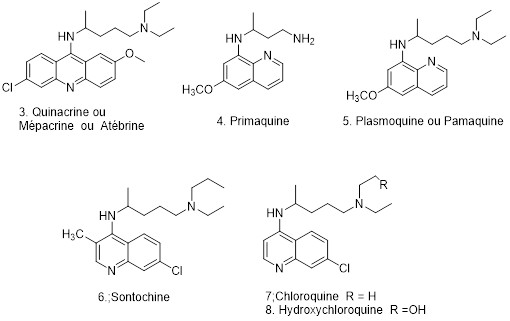
En résumé il y aura ainsi des antipaludiques de synthèse comportant soit un chromophore de type bleu de méthylène (mépacrine ou quinacrine, ou atébrine (3) retirée du marché), soit des 8-amino-quinoléines (primaquine (4) et la plasmoquine ou pamaquine (5), soit des 4-amino-quinoléines (résoquine ou diphosphate de chloroquine, sontoquine ou 3-méthylchloroquine(6), chloroquine ou nivaquine (7) et son dérivé hydroxylé (8). Ceux-ci de coût de fabrication très faible, tendront ensuite à remplacer la quinine d’extraction, plus chère (Figure 2).
Des essais cliniques sont ensuite menés avec la sontochine et la résochine en Tunisie (sous domination allemande) par le Dr Philippe Decourt [22], des laboratoires Rhône Poulenc-Specia qui avaient passé un accord sur la sontochine avec IG Farben en juillet 1941. Les essais montrèrent la bonne efficacité et la bonne tolérance des molécules.
Lui-même raconte : « Le médicament essentiel était une substance colorante jaune, la quinacrine. Elle avait divers inconvénients qui limitaient ses possibilités d’emploi : parfois une coloration jaune de la peau après un traitement prophylactique prolongé ou à un rythme trop rapide, tolérance imparfaite dans certains cas de traitements curatifs. Parmi les corps dont la synthèse avait été faite par les Allemands plusieurs années auparavant se trouvaient des produits ayant une parenté chimique avec la quinacrine, mais blancs. La société Rhône-Poulenc m’en fournit deux, étiquetés Sontochin et Resochin, et plus tard Nivaquine B et C (les deux produits ayant une activité identique). En 1941 il s’agissait d’établir définitivement la valeur thérapeutique de cette série chimique qui n’avait pas encore été l’objet d’essais cliniques : efficacité, meilleure tolérance, possibilité de donner sans inconvénient des doses plus fortes ce qui était important au début des traitements curatifs, absence de coloration même en cas de prophylaxie longtemps prolongée et à rythme plus rapide au cours d’épidémies ou endémies graves. Les essais furent continués en 1942 avec Paul Durand, directeur de l’Institut Pasteur de Tunis, et mon collaborateur Jean Schneider qui avait pu me rejoindre en Tunisie. Après le débarquement allié en Afrique du Nord (après mon départ de Tunisie) Schneider communiqua les produits restants et les résultats obtenus tant en traitement curatif qu’en prophylaxie, au Haut Commandement allié à Tunis. »
Le 23 mai 1943 Schneider est alors transporté à Alger emportant 5000 comprimés de sontochine.
La résochine reçut le nom de chloroquine en février 1946 ; en France, elle fut mise sur le marché en 1949 sous le nom de Nivaquine (de niva neige et quine). Antipaludique de la famille des amino-4-quinoléines, elle a été largement commercialisée non seulement en France mais également aux États-Unis, sous le nom d’ARALEN.
Plus près de nous, trois autres molécules dérivées de la quinine ont vu le jour, la méfloquine, une amino-quinoleïne perfluorée, commercialisée sous le nom de Lariam® (Roche). Dû à de sérieux effets psychiatriques et nerveux [22], la FDA en 2013 a mis en garde contre son utilisation. En 2017, à la suite d’une réévaluation du profil de sécurité de la méfloquine au niveau européen, l’Agence européenne des médicaments (EMA) a conclu que le rapport bénéfice/risque du chlorhydrate de méfloquine n’était pas modifié. Le Lariam ne devra ainsi être envisagé qu’en dernière intention dans la chimioprophylaxie du paludisme, si le bénéfice est jugé supérieur au risque par le médecin prescripteur. Des alternatives mieux tolérées sont à privilégier.
L’halofantrine ou Halfan® est un antipaludique de synthèse (dérivé du phénanthrène dont les études chez l’animal et chez l’homme ont démontré l’efficacité sur différents plasmodes et en particulier sur les souches de Plasmodium falciparum résistantes à la chloroquine. Ayant obtenu l’autorisation de mise sur le marché le 03/05/1988 par GLAXOSMITHKLINE, il a été retiré du marché en mars 2016.

La luméfantrine, de Novartis Pharma dérivée dufluorène. Le Riamet® (AMM en 200 et le Coartem® sont des antipaludiques composés de l’association d’artéméther et de luméfantrine., utilisés par voie orale .En effet compte tenu des résistances acquises des souches de plasmodium, tous ces nouveaux antipaludiques dérivés de la quinine sont recommandés sous forme de combinaisons thérapeutiques à base d’artémisinine et de ses dérivés.
Anti-paludiques de synthèse de troisième génération
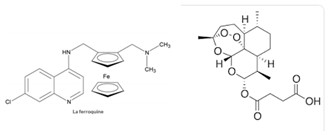
Dernière molécule en date de cette série d’amino-quinoleines, la ferroquine. Sa structure dérive de la découverte du ferrocène dans les années 1950 qui comporte un atome de fer entre deux cycles cyclopentadiényle. Cette découverte a ouvert la voie à la chimie des métaloccènes, composés de même nature mais comportant d’autres atomes métalliques et potentiellement utilisablchimie thérapeutique. Un tel dérivé de la quinine possède une activité in vitro supérieure à celle de la quinine qui pourrait être due à une augmentation de sa lipophilie et de son affinité pour les vacuoles digestives des parasites [23].
Cette molécule est brevetée par Sanofi dans l’association l ‘artefenomel ou OZ439, qui inclue également un analogue semi-synthétique de l’artémisinine, l’artésunate (24).
Autres indications des antipaludiques de synthèse dérivés de la quinine
Les antipaludéens de synthèse sont des bases faibles qui interfèrent avec les fonctions phagocytaires par le biais d’une élévation du pH intracellulaire. Cela entraîne une altération de la présentation sélective des auto- antigènes, de faible affinité, tout en respectant celle des antigènes exogènes, de plus forte affinité. La chloroquine et l’hydroxychloroquine bloquent les réponses lymphocytaires T à la stimulation induite par les mitogènes et inhibent la production de certaines cytokines, d’interféron α et de facteur de nécrose tumorale (TNFα). Ces effets bloquants passent par une inhibition de l’activation du récepteur toll-like, impliqué dans l’immunité innée et dans les pathologies auto-immunes, notamment le lupus, par le biais d’une liaison aux acides nucléiques.
La chloroquine et l’hydroxychloroquine abaissent la clairance de l’insuline et augmentent l’insulinémie, d’où un risque hypoglycémique (en association aux antidiabétiques) et un effet favorable sur le contrôle du diabète. Elles améliorent le profil lipidique, possiblement par le biais d’une diminution de la synthèse hépatique de cholestérol. Elles diminuent l’agrégation plaquettaire. Du fait de ces trois propriétés, l’hydroxychloroquine améliore le profil de risque vasculaire dans le lupus.
L’hydroxychloroquine (une 4-aminoquinoleine) est un traitement majeur du lupus systémique . Elle a été utilisée avec un succès variable dans diverses affections auto-immunes, inflammatoires et infectieuses (comme la polyarthrite rhumatoïde et la sarcoïdose cutanée) en bloquant la formation de l’interféron. Les effets indésirables les plus fréquents sont habituellement bénins et réversibles : effets gastro-intestinaux ; prurit, hypoglycémie (en association aux antidiabétiques oraux) ; céphalée, insomnie, irritabilité, troubles audio-vestibulaires. La complication la plus grave, heureusement très rare, est la cardiomyopathie, qui peut conduire à une insuffisance cardiaque parfois irréversible.
Activité antivirale
Depuis la fin des années 1960, la chloroquine — testée pure ou sous forme de sels, ou d’hydroxychloroquine — a souvent eu in vitro des effets prometteurs pour la lutte contre des maladies virales aiguës. Toutefois, les études cliniques chez l’homme n’ont jamais été suffisamment concluantes pour inclure ces molécules dans les recommandations thérapeutiques, que ce soit pour le SIDA en 1990, le virus H5N1 de la grippe aviaire, le chikungunya en 2003, l’hépatite C en 2016, le virus Zika en 2017ou encore la dengue. Certaines études ont même conclu à des effets défavorables. Ainsi dans le cas du chikungunya, non seulement la chloroquine n’est pas efficace, mais elle peut même aggraver la réplication du virus et peut avoir des effets négatifs après coup (25].
La seule étude contrôlée qui a conclu à une efficacité de l’hydroxychloroquine chez l’homme dans une affection virale est une étude égyptienne [26] qui montrait que l’adjonction d’hydroxychloroquine à d’autres médicaments chez des patients atteints d’hépatite C contribuait significativement à baisser la charge virale plasmatique et le taux d’ALAT (un enzyme hépatique). Cependant, cette étude n’a pas été répliquée. La chloroquine pourrait même favoriser la réplication de certains virus en diminuant la réponse immunitaire et la réaction anti-inflammatoire. Même constat général dans le cas du VIH, avec des résultats contradictoires, dont des effets négatifs comme l’aggravation de la baisse des lymphocytes CD4 et l’augmentation de la réplication virale.
Selon une publication de 2005 [27] la chloroquine est en culture cellulaire, un puissant inhibiteur du coronavirus SARS selon un mode d’action non complétement élucidé : élévation du pH endosomal inhibant l’entrée du virus dans la cellule, prévention de la glycosylation terminale des immunoglobulines etc.
Cette molécule, sous sa forme hydroxylée, fait actuellement l’objet de nombreux débats concernant le bien-fondé ou non de son utilisation dans le traitement de la Covid 19.
Bibliographie
- Avenas P.6. A propos de la quinine, L’Actualité Chimique , 2014, 390 , p. 6.
- Bodo B. Acte 1 . Le quinquina, remède du nouveau monde pour une maladie de l’ancien : légendes et réalités d’une découverte. https://www.mediachimie.org/valeur/gratuit.
- Dictionnaire d’histoire de la pharmacie. Des origines à la fin du XIV siècle. Sous la direction d’Olivier Lafont. Pharmathèmes 2003.
- Carl von Linné, Species plantarum :exhibentes plantas rite cognitas, …, Holmiae :Impensis Laurentii Salvii, 1753 (lire en ligne[archive])
- Léonardo Gutierrez-Golomer. Confusions historiques à propos du quinquina. Revue d’histoire de la Pharmacie 1968 ; 199 : 187-190
- La quinologie de Delondre et Bouchardat . Consulté sur https://bibulyon.hypotheses.org/10271
- VESALIUS, Louis XIV et le quinquina, 2003, IX , 2 , p.25 – 30 , consulte sur: ettps://www.biusante.parisdescartes.fr/ishm/vesalius/vesx2003x09x02x025x030.pdf
- Ambroise-Thomas. La petite et la grande histoire du paludisme. Rapport Académie nationale de Médecine 2007.Consuklté sur : http://www.academie-medecine.fr/la-petite-et-la-grande-histoire-du-paludisme/
- Callot J. Un problème complexe : la régression du paludisme en France. Annales 1947 ; 2-3 : 328-335
- Lettre de Lettres de Madame Roland de 1780 à 1793/Lettres/1782. Consulté sur : https://fr.wikisource.org/wiki/Lettres_de_Madame_Roland_de_1780_%C3%A0_1793/Lettres/1782
- Arnaud de Saint Jouan M. . Le château de Lagaraye, Bulletin de la Société Nationale des Antiquaires de France, 1990 – 1988, p. 25-39.
- Un arrêt du Conseil d’Etat en date du 22 mars 1735, interdit l’entrée en France du faux quinquina ou quinquina femelle ; rapporté dans « Sur l’essai des médicaments en France avant 1789 par Bouvet M. Revue d’Histoire de la Pharmacie 1956 ; 149: pp. 305-316.
- Baumes JBT. Traité des fièvres rémittentes et des indications qu’elles fournissent pour l’usage du quinquina 1821 ; volume 2 page 389.
- Feltgen K. Hommage à Antoine François de FOURCROY (1755 – 1809) à l’occasion du bicentenaire de sa mort. CHU Rouen. 2009 consultable sur : https://www.chu-rouen.fr/wp-content/uploads/sites/2/2017/04/Hommage-a-Antoine-Francois-de-Fourcroy-1755-1809-a-loccasion-du-bicentenaire-de-sa-mort-Dr.-Karl-Feltgen-GHHR-decembre-2009.pdf
- Deschamps, Procédé pour extraire le sel à base de chaux que contient le quinquina jaune. Ann. Chimie, 1803 (an XII), 48, p. 65-73.
- Flahaut J. LES DESRONES, Pharmaciens parisiens de 1779 à 1855. Revue d’histoire de la pharmacie, 2005, 346, p.221-234.
- Rossignol P. Les travaux scientifiques de Joseph Pelletier. Revue d’histoire de la pharmacie. 1989 ; 281-282 : 135.
- Pelletier PJ, CaventouJ.B., Recherches chimiques sur les quinquinas, Ann. Chimie Phys. 1820, 15,p. 289-318.
- Double MJ. Considérations thérapeutiques sur une nouvelle préparation du quinquina. J Général Med Chirurgie, Pharma. 1821 ; 74 : 50-75.
- Kaufman T, Ruveda E A The quest for quinine; those who won the battles and those who won the war. Ang. Chem. Intl Ed., 2005, 44, p. 854-885.
- Decourt P. « Principes de l’étude pharmacologique des antipaludiques » sur les expériences de laboratoire (dans Actualités pharmacologiques, deuxième série, 1950, Masson édit.),
- Remington L, Nevin A serious nightmare : psychiatric and neurologic adverse reactions to mefloquine are serious adverse reactions. Pharmacol Res Perspect 2017 ; 5(4) : e00328
- Biot C, Nosten F, FraisseL et al.. The antimalarial ferroquine : from bench to clinical. Parasite 2011 ; 18(3) : 207-214.
- Supan C, Mombo-Ngoma G, Kombila M et al. Phase 2a, Open-Label, 4-Escalating-Dose, Randomized Multicenter Study Evaluating the Safety and Activity of Ferroquine (SSR97193) Plus Artesunate, versus Amodiaquine, in African Adult Men with Uncomplicated Plasmodium falciparum Malaria. Am J Trop Med Hyg. 2017; 97(2): 514.
- Roques P, Thiberville SD, et al. Paradoxical effects of chloroquine treatment in enhancing Chikungunya virus infection. Viruses 2018 ; 10 : 268.
- Helal GK, Gad MA, Abd-Ellah MF, Eid MS. Hydroxychloroquine augments early virological response to pegylated interferon plus ribavirin in genotype-4 chronic hepatitis C patients. J Med Virology 2016; 88; 2170.
- Vincent MJ et al. Chloroquine is a potent inhibitor of SARS coronavirus infection and spread. Virology Journal 2005 ; 2 : 69.

